О Руководстве по общим вопросам клинических исследований
В каждом документе отражены все принятые к нему изменения. Имеется возможность получения документа с набором изменений, актуальным на конкретную дату в прошлом архивная версия. Интерфейс системы оптимизирован для дисплеев мобильных устройств. Просмотр документов раздела «Избранное» возможен без подключения к сети Интернет.

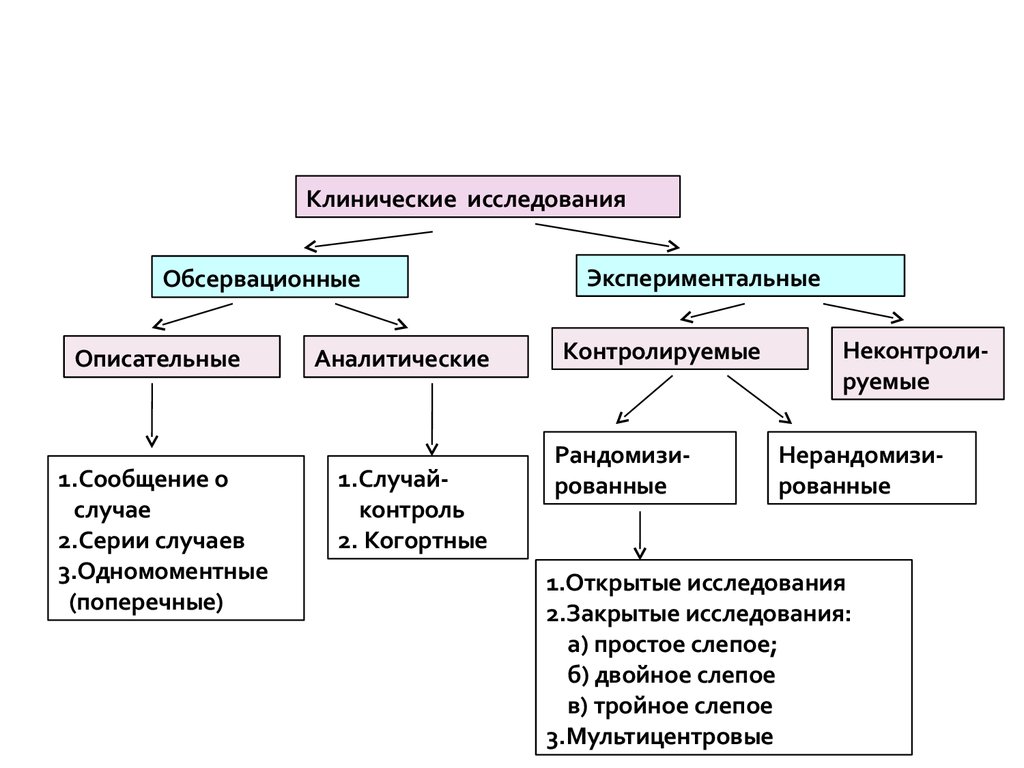



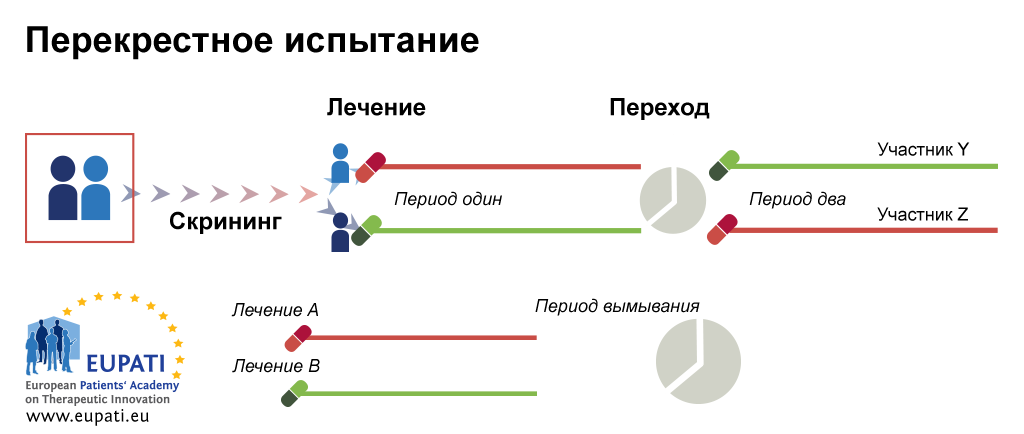




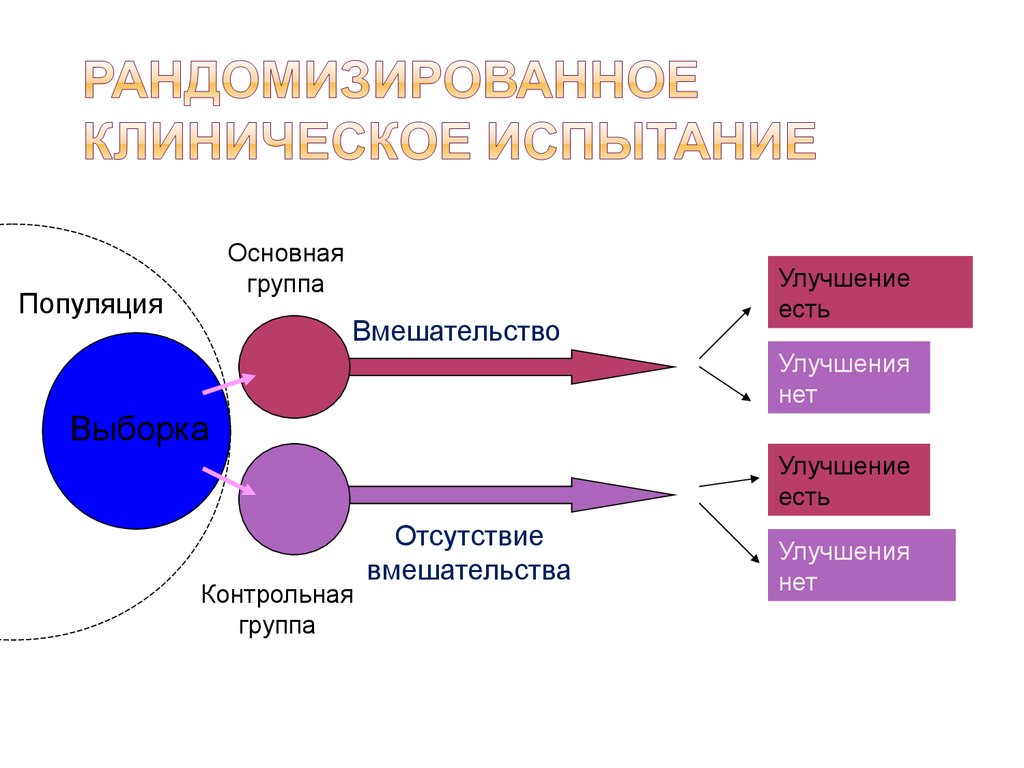
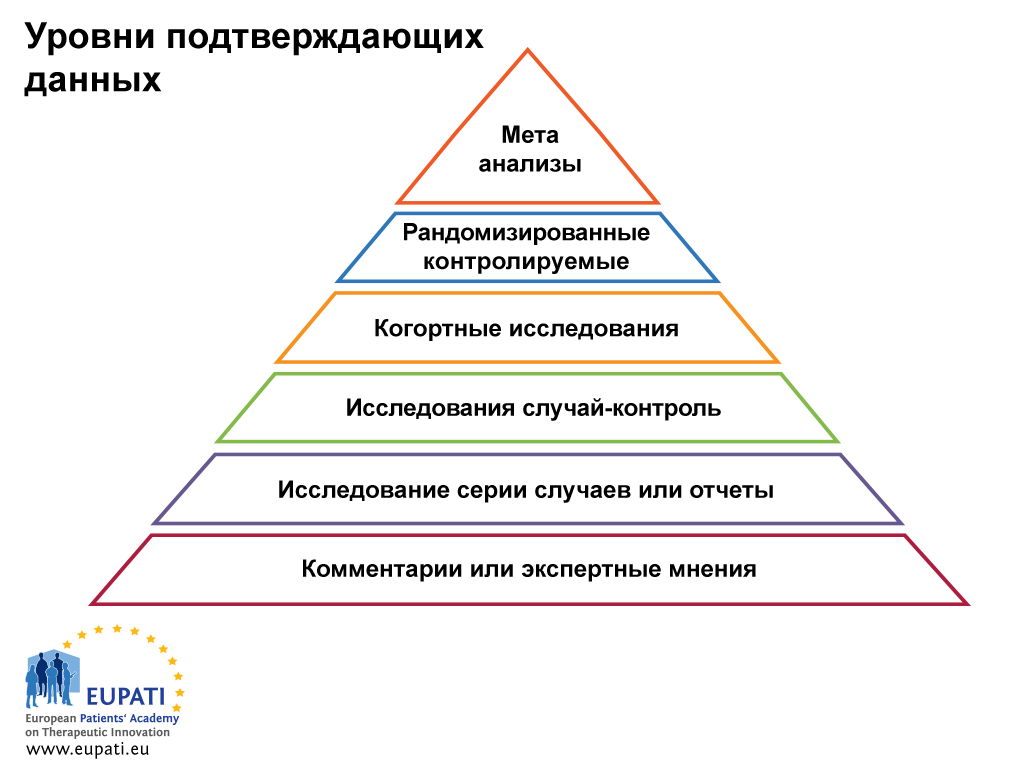
Цель данного раздела — дать общее определение клинических исследований, которые проводятся на людях:. Это определение относится не только к запланированным клиническим исследованиям с участием людей в качестве субъектов, но и к исследованиям, в которых факторы окружающей среды изменяются таким образом, что может случайно подвергнуть людей чрезмерному риску». Полная информация должна быть задокументирована в отношении терапевтических показаний, метода введения и дозировки, противопоказаний, предупреждений, мер безопасности, мер предосторожности, взаимодействий, воздействия на целевые группы населения и информации о безопасности. В процессе клинических исследований и разработок большинство медицинских продуктов будут проверяться на безопасность и эффективность только в краткосрочной перспективе на ограниченном числе тщательно отобранных лиц.




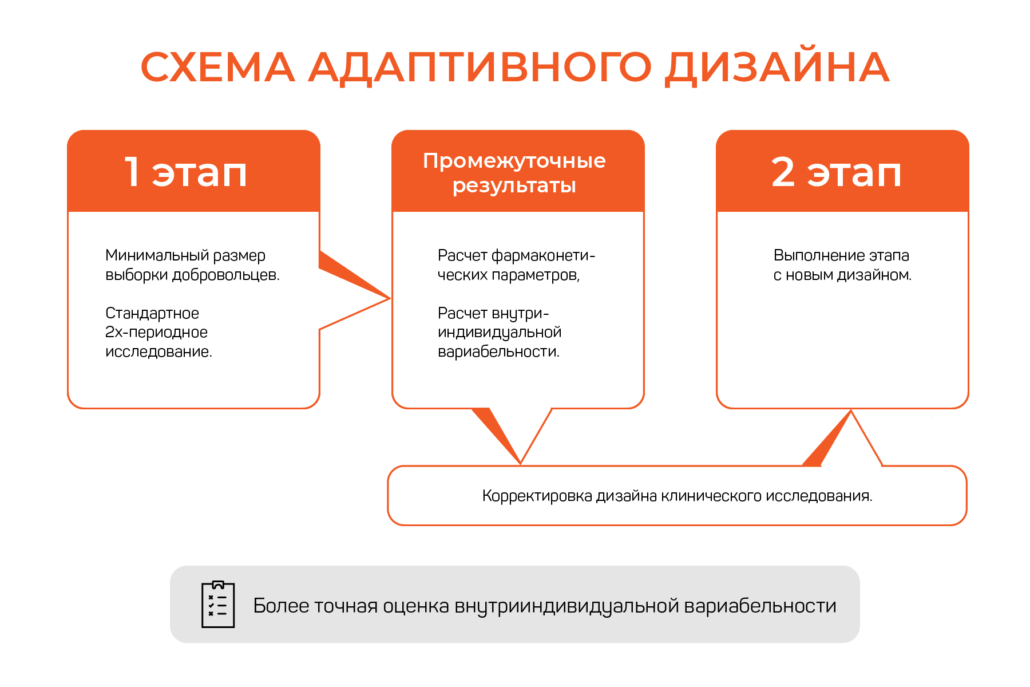
_Clinical_Trial_Design_after_PMID_29490655.png/400px-Schematic_block_diagram_of_Adaptive_(Pharmaceutical)_Clinical_Trial_Design_after_PMID_29490655.png)




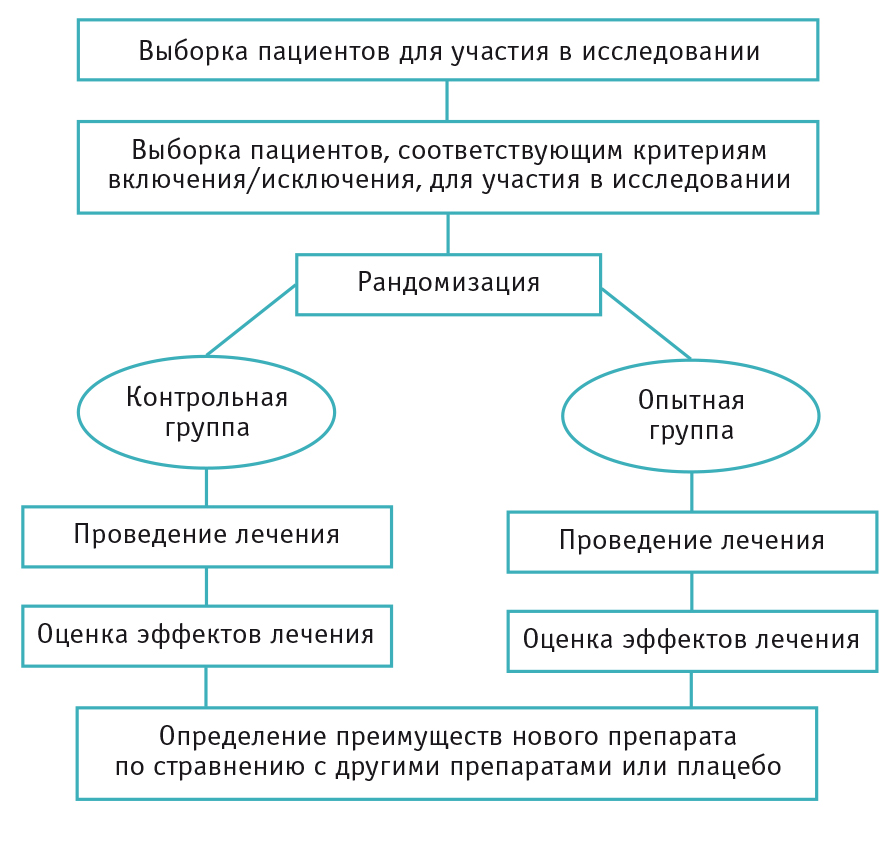




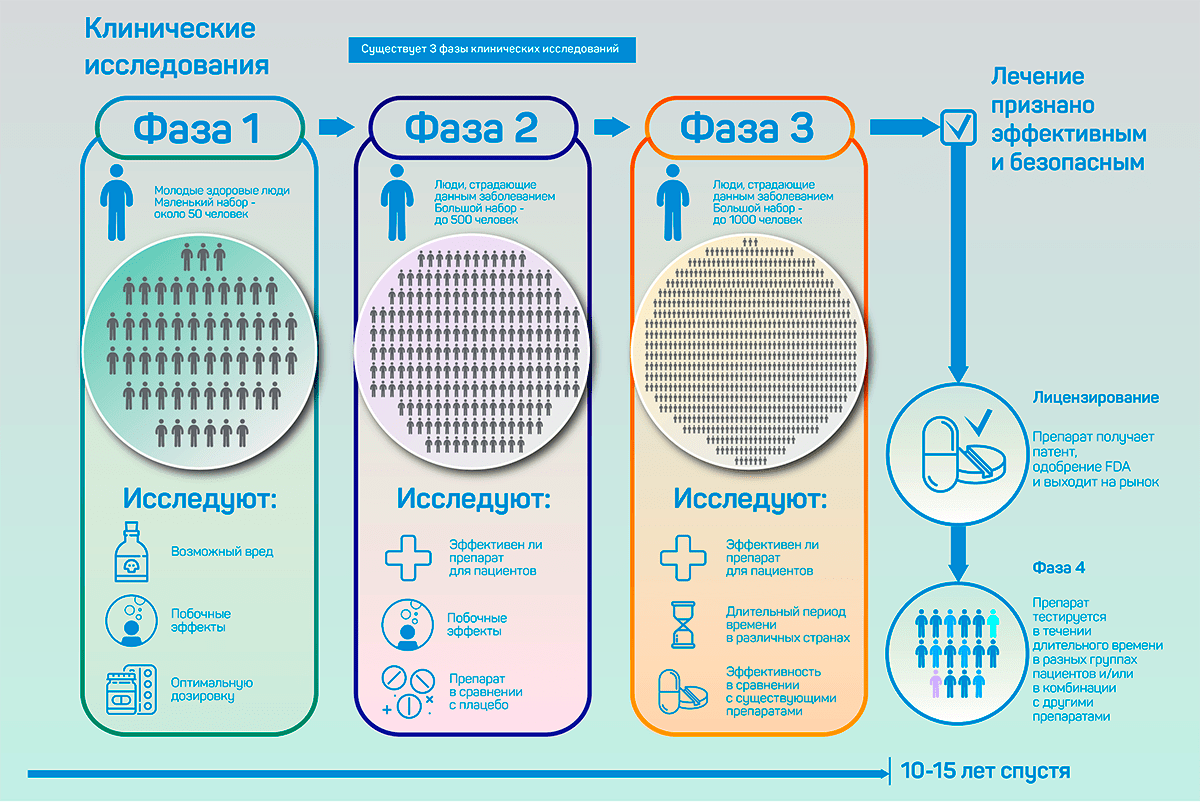
Клиническое исследование — научное исследование, которые необходимо провести в процессе разработки лекарственного препарата перед его выводом в продажу. Исследование состоит из 4 основных этапов, описанных в соответствующем документе. Протокол клинического исследования лекарственного препарата — документ, в котором содержатся инструкции для всех участников, с описанием задач и указаниями по их выполнению.